L'atomo in chimica: quali sono le unità di misura
Nel campo della chimica, le unità di misura giocano un ruolo chiave, fungendo da linguaggio comune che permette agli scienziati di tutto il mondo di comunicare scoperte, condurre esperimenti e condividere conoscenze con precisione e coerenza.
Ogni misurazione in chimica, sia che si tratti della massa atomica di un elemento o della concentrazione di una soluzione, si basa su standard internazionalmente riconosciuti, stabiliti dal Sistema Internazionale di Unità (SI), garantendo così che i dati siano trasferibili e comparabili ovunque.
Come si fa a misurare qualcosa di tanto piccolo che nemmeno si vede? Un atomo, ad esempio? Come possiamo sapere da quanti atomi è composto un qualsiasi oggetto? Come si misurano le dimensioni e il peso degli atomi? E come si fa a contarli? Vediamolo insieme!
La misura della dimensione dell’atomo
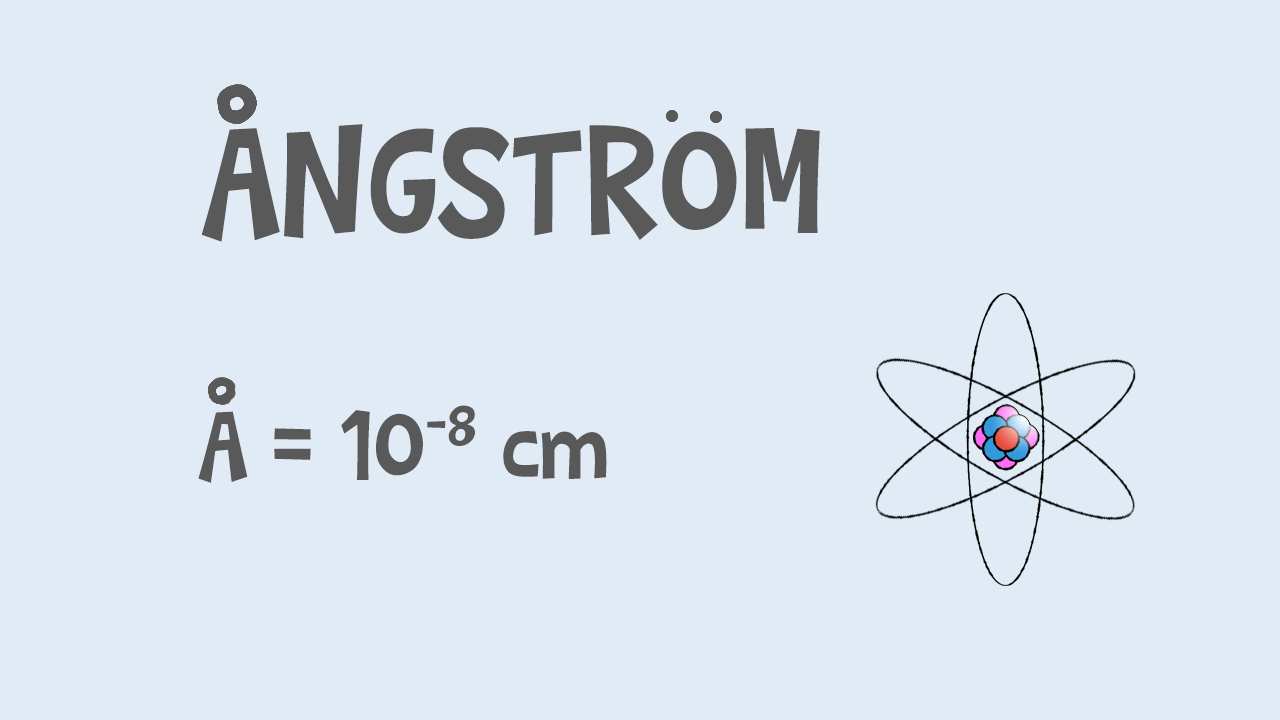
I chimici si sono posti questo problema, perché gli atomi, ossia le particelle più piccole di cui è composta la materia, hanno davvero dimensioni piccolissime, tanto che se dovessimo esprimerle in metri dovremmo scrivere un numero come £$0,0000000001\text{ m}$£ £$({10}^{-10}\text{ m})$£.
Per evitare di scrivere numeri così lunghi, le dimensioni degli atomi si esprimono in Angstrom, il cui simbolo è £$Ǻ$£, un’unità di misura di lunghezza che vale £${10}^{-8}\text{ cm}$£; è quindi un sottomultiplo del metro.
Il raggio di un atomo è circa di £$1$£ £$\text{Angstrom}$£.
Misurare il peso dell’atomo

Lo stesso problema si pone quando vogliamo pesare un atomo o i suoi costituenti (protoni, elettroni e neutroni); non esistono bilance tanto piccole! Per questo, anziché utilizzare i £$kg$£, si usano i Dalton; un Dalton è pari alla massa di un protone ed equivale a £$1,6\times{10}^{-24}$£ grammi.
Per meglio comprendere quanto siano leggeri gli atomi, basta pensare che un milione di miliardi di miliardi di protoni pesa solo un grammo.
Come contare gli atomi: la mole

Servono tantissimi atomi anche per costruire il più piccolo degli oggetti! Ebbene sì, e questo rende complicato contarli.
Ma così come si parla di dozzina per indicare un gruppo di £$12$£ cose uguali, per gli atomi e le molecole si utilizza una grandezza fondamentale che si chiama mole: in chimica è la quantità di atomi contenuti in £$12$£ grammi di Carbonio, un particolare elemento chimico, ma può essere usata per contare qualsiasi sostanza.
Ad esempio, ci sono altrettante molecole anche in una mole d’acqua, che pesa appena £$18$£ grammi. Il suo valore è pari a £$6,022\times{10}^{23}$£, oltre seicentomila miliardi di miliari; un numero davvero grande, ma tutti questi atomi starebbero comodamente su un cucchiaio!
Questo numero è anche chiamato Costante di Avogadro: il nome deriva dal chimico e fisico Amedeo Avogadro.
