Le formule chimiche: nomenclatura e composti
La nomenclatura dei composti chimici è un sistema metodico e standardizzato per nominare le varie sostanze chimiche, essenziale per facilitare la comunicazione e la comprensione tra gli scienziati e gli studenti di chimica in tutto il mondo.
Questo sistema di denominazione segue regole precise stabilite da organizzazioni internazionali come l’Unione Internazionale di Chimica Pura e Applicata (IUPAC), garantendo che ogni composto chimico abbia un nome univoco e universalmente riconosciuto.
Esploriamo nel dettaglio le regole e le convenzioni utilizzate nella nomenclatura chimica, affrontando la classificazione dei vari tipi di composti, tra cui quelli inorganici come sali, ossidi e acidi, e quelli organici, che includono idrocarburi, alcoli e esteri.
- Le formule in chimica
- La nomenclatura dei composti chimici
- Tabella delle denominazioni dei composti chimici
- Le formule dei composti chimici nella quotidianità
Le formule in chimica
Una molecola può contenere due atomi oppure molti di più. Ecco perché esiste la necessità di saperle rappresentare utilizzando le formule.
Le formule chimiche possono essere:
- Formule GREZZE in cui si indicano i simboli di cui è composta la molecola, inserendo il numero corrispondente agli atomi che la compongono.
Ad esempio, quando si indica l’acqua con la formula H2O, capiamo che esistono due atomi di idrogeno e un atomo di ossigeno.
Oppure, se vogliamo indicare l’idrossido di calcio con la formula Ca(OH)2, capiamo che ossigeno e idrogeno sono formati da due atomi mentre il calcio da uno solo.
- Formule DI STRUTTURA in cui, oltre agli atomi che compongono la molecola, vengono indicati i tipi di legami (singoli, doppi o tripli).
Ad esempio l’acqua si indicherà con la formula H-O-H, mentre l’acido cloridrico si indicherà con la formula O=Cl-O-H dove si può notare che il cloro ha un doppio legame con un atomo di ossigeno e un legame singolo con il secondo atomo di ossigeno.
La nomenclatura dei composti chimici
La nomenclatura dei composti chimici è un elemento cruciale nel campo della chimica, poiché fornisce un linguaggio comune e standardizzato che consente ai ricercatori, agli educatori e agli studenti di identificare in modo preciso le sostanze chimiche.
Le regole di denominazione variano a seconda della tipologia del composto, distinguendo tra composti inorganici e organici, e includono dettagli su come nominare gli atomi, i gruppi funzionali, le molecole complesse e le strutture polimeriche.
I composti chimici più comuni sono formati da ossigeno e un metallo e sono detti ossidi basici, mentre quelli formati da ossigeno e un non metallo sono detti ossidi acidi:
- Facendo reagire con acqua gli ossidi basici si ottengono gli idrossidi, che sono formati da un metallo seguito dal gruppo OH.
- Facendo reagire con acqua gli ossidi acidi si ottengono gli ossoacidi (o acidi), che sono formati da un atomo di idrogeno seguito da un non metallo e poi da ossigeno. Gli idrossidi messi a contatto con gli acidi reagiscono e alla fine si otterrà un sale più acqua.
L’ossido idrato di ferro (o ruggine) si forma per ossidazione del ferro esposto all’umidità atmosferica.
Gli acidi che non contengono ossigeno sono chiamati acidi binari o idracidi e nella formula si scrive prima l’idrogeno poi il non metallo.
Ci sono anche i sali binari o idruri, che si scrivono indicando prima il metallo e poi il non metallo.
Tabella delle denominazioni dei composti chimici
| CLASSI | ELEMENTI | FORMULA | ESEMPIO |
| Ossidi basici | Metallo, ossigeno | Me O | AI2O3 |
| Ossidi acidi | Non metallo, ossigeno | NonMe O | SO2 |
| Idruri metallici | Metallo, idrogeno | Me H | LiH |
| Idruri covalenti | Non metallo, idrogeno | nonMe H | CH4 |
| Idrossidi | Metallo, ossigeno, idrogeno | Me OH | LiOH |
| Acidi Binari (idracidi) | Idrogeno, non metallo | H nonMe | HCl |
| Acidi Ternari (ossiacidi) | Idrogeno, non metallo, ossigeno | H nonMe O | KNO3 |
| Sali Binari (di idracidi) | Metallo, non metallo | Me nonMe | KBr |
| Sali Ternari (di ossiadici) | Metallo, non metallo, ossigeno | Me nonMe O | CaSO4 |
Acidi e basi

Gli acidi e le basi sono classi di composti chimici con un comportamento caratteristico: le basi neutralizzano l’acidità degli acidi, gli acidi neutralizzano la basicità delle basi.
Nel passato vennero date definizioni di acidi e basi a seconda degli ioni o dei protoni ceduti o acquisiti, ma negli anni queste teorie furono superate. Quella più vicina a noi è la teoria del chimico americano G. Lewis che, nel 1923, definisce gli acidi come sostanze in grado di accettare una coppia di elettroni, mentre una base è una qualsiasi sostanza in grado di cedere una coppia di elettroni non condivisi.
Oggi per noi gli acidi sono in grado di corrodere i metalli e di sciogliere il calcare e possono essere più o meno forti grazie al loro PH. Le basi solitamente hanno un sapore amaro e a contatto con le dita sono viscide.
Per individuare se una sostanza è acida o basica si utilizzano delle sostanze chiamate indicatori. Ve ne sono di diverso tipo anche in commercio, ma la più comune è una cartina formata da diverse sostanze, chiamata indicatore universale, che assume colori diversi in base al PH della soluzione e i gradi del PH vanno da 0 a 14:
- PH=0 corrisponde a un’acidità molto forte
- PH=7 corrisponde alla situazione neutra
- PH=14 è una sostanza fortemente basica
Per misurare il PH esiste anche uno strumento digitale chiamato Phmetro che effettua misurazioni molto precise e immediate.
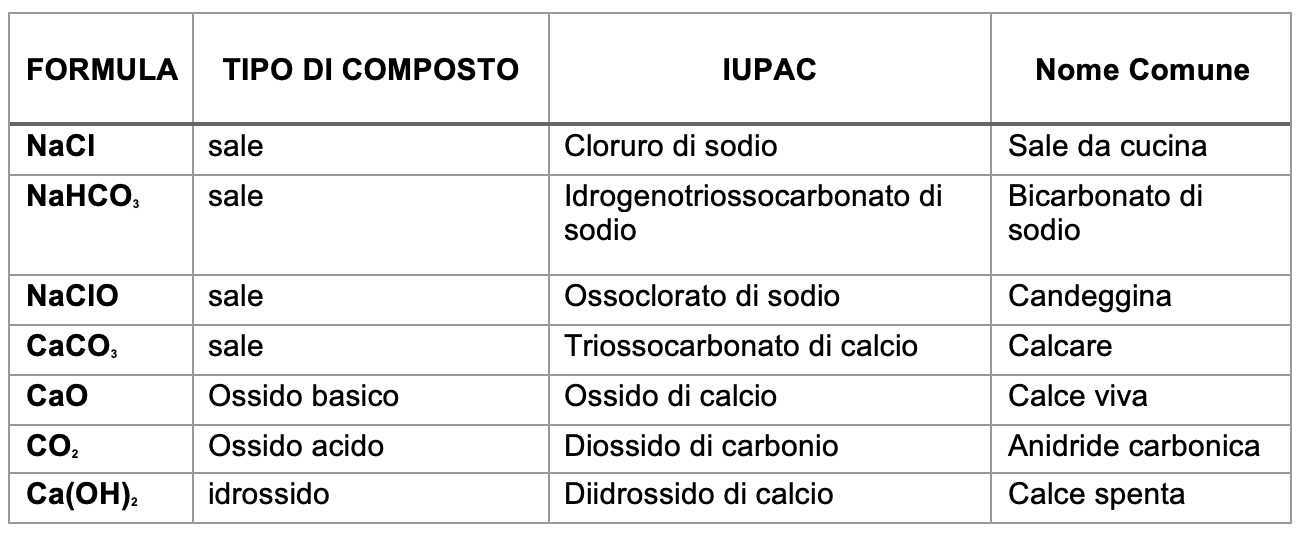
Le formule dei composti chimici nella quotidianità
Vediamo un elenco di alcuni composti chimici che ritroviamo nella vita di tutti i giorni, senza nemmeno saperlo!